SAXS 和 UV/Vis 联用测量对生物样品分析的优势
- 关键词:SAXS,UV/Vis, X射线散射
- 摘要:小角 X 射线散射 (SAXS) 是结构生物学中一种强大的方法,能够在溶液中,即在自然状态下表征分子结构。 SAXS 通常将其潜力与其他方法结合起来,以帮助解释数据或评估颗粒单分散性的要求。
1 简介
小角 X 射线散射 (SAXS) 是结构生物学中一种强大的方法,能够在溶液中,即在自然状态下表征分子结构。 SAXS 通常将其潜力与其他方法结合起来,以帮助解释数据或评估颗粒单分散性的要求。紫外和可见光吸收光谱就是这样一种互补技术。通常,它用于在各种条件下测量分子浓度或监测样品变化(如聚集)。UV/Vis 光谱可以在非常小的样品体积下和在有限的空间内进行,这使得它非常适合与其他方法相结合的原位应用。将 SAXS 与原位 UV/Vis 吸收光谱相结合,可以在相同的样品体积上同时使用这两种方法对样品进行表征。例如,本报告重点介绍了蛋白质样品的浓度测量和温度诱导聚集监测。
1.1 浓度系列
蛋白质分子是带电颗粒,在溶液中趋于自组装。由于电荷的存在,这会导致颗粒间的排斥力。为了减少对 SAXS 数据的影响,通常会进行一系列不同浓度的测量,然后将测量数据外推至零浓度。因此,必须知道特定样品的精确浓度。溶液中的蛋白质浓度可通过波长 280 nm 紫外光吸收来测量。利用 Lambert-Beer’s 定律,其浓度可以直接与吸光度联系起来: A = εlc 其中 A 是吸光度, ɛ 摩尔吸光系数, l 光程长度和 c 是吸光物浓度。因此,原位测量 UV/Vis 吸光度也可转化为 SAXS 测量的实际样品浓度。
1.2 温度稳定性
蛋白质分子也可能会有颗粒间相互吸引作用,如聚集。聚集通常使得分子从溶液中沉淀,这可通过光学观察到。在吸收光谱中,由于光在粒子上的散射,它转化为可见光范围内吸收的增加。对于 SAXS,聚集通常是阻碍单分散性要求的因素,然而,仅从 SAXS 数据,有时候很难区分聚集和其他效应。在这项工作中,显示了热诱导聚集对紫外-可见吸收和 SAXS 的影响。
2 实验细节
2.1 实验设置
实验采用 Anton Paar SAXSpoint 系统,配备了 2.3 浓度测量将储存的溶液分别稀释至 2.5 mg/ml, 5 mg/ml, 10 mg/ml 和 20 mg/ml。SAXS 测量,样品曝光时间 6 x 30 s,数据收集范围 q 从从 0.08 nm-1 到 4 nm-1。UV/Vis 光谱测量,在 200 nm 至 500 nm 的波长的波长范围内,每 60s 收集一次数据,每个点的平均时间为 0.2s。在相同的条件下测量等效的缓冲液 Excillum MetalJet X 射线源(图 1),Dectris 。 EIGER R 1M 探测器和定制的 UV/Vis 样品台。样品台是一个改进的流动毛细管,可以使用自动进样器。集成到样品台的 Peltier 元件可控制样品的温度。在样品的相同位置,与 X 射线束垂直方向测量 UV/Vis 吸收。Agilent CaryUV 60 光谱仪用于产生单色光(190-1100 nm),通过光纤将单色光导到样品处。使用安装的专用探测器来记录透过样品的光,该探测器直接记录光束位置处的吸收光量,确保 SAXS 和 UV/Vis 测量相同的样品体积。 UV/Vis 光谱测量,在 200 nm 至 500 nm 的波长范围内,每 60s 收集一次数据,每个点的平均时间为 0.2s。在相同的条件下测量等效的缓冲液。
2.2 测量
将来自牛甲状腺(Sigma-Aldrich)的甲状腺球蛋白(TG)溶解在 20 mM Tris, 100 mM NaCl, pH 7.4 中,最终浓度为 20 mg/ml。通过添加相应量的缓冲溶液,进一步降低浓度。样品装在 1 mm 石英毛细管中进行测量,使用 ASX(-c) 自动进样器自动加载 25 µl 样品。 SAXS 数据和 UV/Vis 数据可以同时测量。
2.3 浓度测量将储存的溶液分别稀释至 2.5 mg/ml, 5 mg/ml, 10 mg/ml 和 20 mg/ml。SAXS 测量,样品曝光时间 6 x 30 s,数据收集范围 q 从从 0.08 nm-1 到 4 nm-1。UV/Vis 光谱测量,在 200 nm 至 500 nm 的波长的波长范围内,每 60s 收集一次数据,每个点的平均时间为 0.2s。在相同的条件下测量等效的缓冲液。
2.4 温度稳定性测量 10 mg/ml 的甲状腺球蛋白。每个 SAXS 测试之前,样品以 5 K/min 的速率加热,并等待时间为 5 min。每个温度点(从 293K 到 343K 间),样品曝光 12 x 30 s 。加热期结束后,样品分几步进行冷却。在 200 nm 至 500 nm 波长范围内,每 30 s 收集一次紫外-可见光谱,每个点的平均时间为 0.2s。293 K 下测量等效的缓冲液 30 x 30 s。
3 结果
3.1 浓度测量
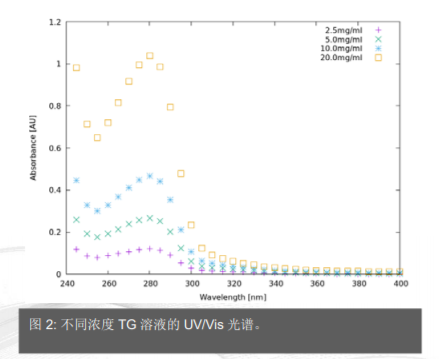
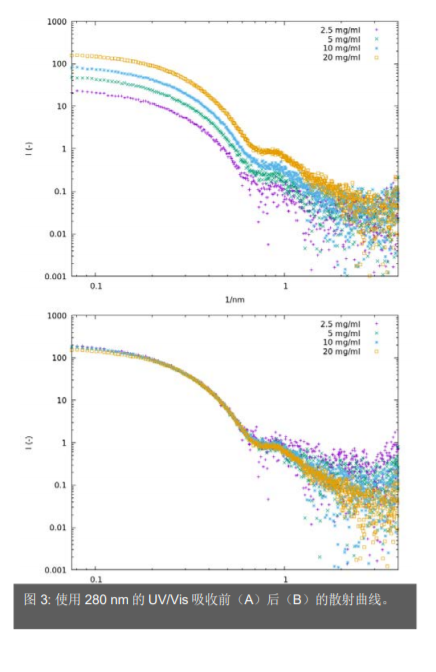
每个样品的测量都使用缓冲溶液样品进行平均和修正,包括 UV-Vis 光谱(图 2)和 SAXS(图 3A)。两种方法均显示了浓度对测量数据的明显影响。测量的毛细管是柱状形状,由于样品厚度的变化和毛细管壁的再反射效应,很难估算实际光程差。因此,仅使用 280 nm 测量的吸收数据进行 SAXS 数据比较。数据曲线显示好的吻合和可用于做进一步的分析(图 3B)。
3.2 温度稳定性
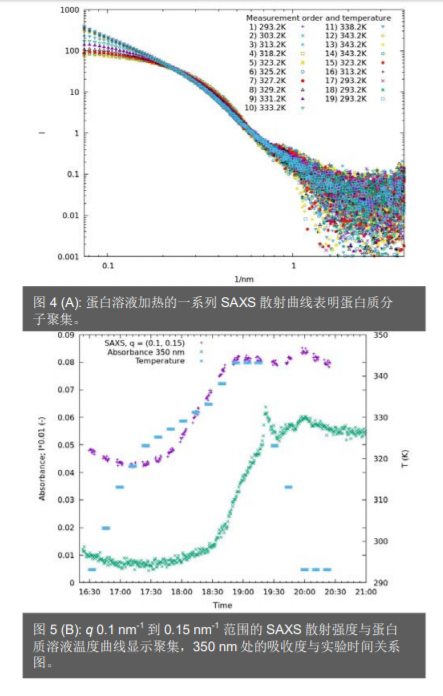
吸收光谱中的聚集通常显示 350 nm 处非零吸收度。对 SAXS,较大的聚集颗粒会导致低角度区域的散射强度增加(图 5A)。因此,对于每个测量的 UV/Vis 关谱和 SAXS 曲线,提取 350 nm 处的吸光度和 q 范围(0.1;0.15)内的平均散射强度(图 5B)。两条曲线均显示了蛋白质解链的典型特征,但是, SAXS 曲线与从 UV/Vis 实验中获得的图略有偏移。这表明解链可能在较低的温度下就开始了,并且 SAXS 对蛋白质变性的早期迹象更为敏感,因为 SAXS 在早期阶段就能检测到结构变化。
4 结论
将 SAXS 与原位 UV/Vis 吸收光谱相结合,可以通过互补手段监测样品的状态。这提供了 SAXS 测量过程中曝光处样品的精确浓度信息,有助于使用 SAXS 进行尺寸排阻色谱(SEC)实验。这两种方法在研究蛋白质聚集方面也相互补充,因为它们与不同类型的颗粒会有相互作用。除了直接的科学意义外,UV/Vis 吸收还可以帮助 SAXS 操作员诊断日常问题,如毛喜欢的清洁度、样品在光束中的位置稳定性、和气泡形成等。
更多精彩内容,请关注:https://www.anton-paar.cn/products/group/saxs/?utm_source=gongkong&utm_medium=online-ad&utm_campaign=cn_C-00040030_online-portal